Технология переработки нефти и газа. Часть 1Механизм основных реакций
Механизм реакций гидрогенизационных процессов на бифункциональных катализаторах исследован достаточно глубоко. Большинство исследований было проведено с использованием образцов составов, в основном парафинов, и, в меньшей степени, нафтеновой алкилароматики и полиароматических углеводородов. Были исследованы также пути реакций для преобразования некоторых видов промышленного сырья и составов гетороциклических углеводородов.
Механизм реакций гидрокрекинга - карбоний-ионный, т.е. механизм каталитических реакций крекинга, объединенный с реакциями изомеризации и гидрогенизации. Хотя начальные реакции гидрокрекинга подобны соответствующим при каталитическом крекинге, присутствие избытка водорода и гидрирующего компонента в составе катализатора приводит к продуктам гидрогенизации и препятствует прохождению некоторых вторичных реакций, таких как коксообразование и повторный крекинг. 6.2.1. Гидроконверсия парафинов
Механизм гидропреобразования парафинов на бифункциональных аморфных катализаторах был подробно изучен в 1960-х годах. Был предложен карбоний-ионный механизм, подобный ранее описанному механизму для катали-тического крекинга, с дополнительной гидрогенизационной и скелетной изомеризацией.
Гидрокрекинг n-парафинов на бифункциональном катализаторе проходит по следующим стадиям:
Адсорбция n-парафинов на металлических центрах
Дегидрогенизация с образованием n-олефинов
Десорбция с металлических центров и диффузия к кислотным центрам
Скелетная изомеризация и/или крекинг олефинов на кислотных центрах через промежуточные карбонийионы.
Десорбция образовавшихся олефинов с кислотных центров и диффузия к металлическим центрам
Гидрирование этих олефинов (n- и изо-) на металлических центрах
Десорбция полученных парафинов
Элементарные реакции, соответствующие описанному выше пути реакции показаны в Таблице 6.2. Анализ продукта показал, что всякий раз, когда возможны несколько путей реакции, предпочтительны те, которые ведут к формированию и последующему крекингу третичного карбонийиона (реакции (d) и (e) в Таблице 6.2) . Реакции гидрированиядегидрирования и изомеризации являются обратимыми, в то время как реакции крекинга необратимы.
3. Типы изомеризации и механизмов β-разрыва.
Перегруппировка вторичных алкилкарбонийионов может вести к другому вторичному карбонийиону путем смещения (изомеризация типа A), или к третичному алкилкарбонийиону (ветвление) посредством протонированногоциклопропана (PCP) посредник (изомеризация типа B) (Таблица 6.3). Скорость изомеризации типа A обычно выше чем типа B. β -разрыв может вести к формированию третичных и вторичных карбонийионов, но не к образованию первичных карбонийионов. Несколько механизмов β -разрыва были предложены для крекинга разветвленных вторичных и третичных карбонийионов (Рисунок 6.1) , Типβ -разрыва, при котором третичный карбонийион преобразуется в другой третичный карбонийион, имеет самую высокую скорость реакции и наиболее вероятен. Скорости реакций уменьшаются в следующем порядке: A>> b1> b2> C. Нужно обратить внимание на то, что каждый тип реакции требует минимального числа атомов углерода в молекуле и определенный тип ветвления для того, чтобы произойти.
Предложенные механизмы β -разрыва наводят на мысль, что n-парафины сырья гидрокрекинга могут несколько раз изомеризоваться, пока не будет достигнута конфигурация, благоприятная для β -разрыва. Крекинг изомеров происходит предпочтительно около центра цепи углеводорода, и образования метана или этана практически не наблюдается. Для больших карбоний-ионов наиболее вероятен крекинг по β -разрыву с образованием вторичных и третичных изомеров, чем с образованием неразветвлен-ных осколков . Кроме того, крекинг парафинов с более низкой относительной молекулярной массой посредством β -разрыва менее вероятен, что объясняет их высокие выходы даже при высоких значениях конверсии.
Скорость гидропреобразования индивидуальных парафинов и на аморфных катализаторах и на катализаторах на основе цеолита, типа Pt/CaY и Pt/USY , увеличивается с увеличением длины цепи. Для продукта гидро-крекинга наблюдается высокое отношение изо-парафинов к н-парафинам. Это обусловлено прежде всего изомеризацией вторичных карбоний-ионов в

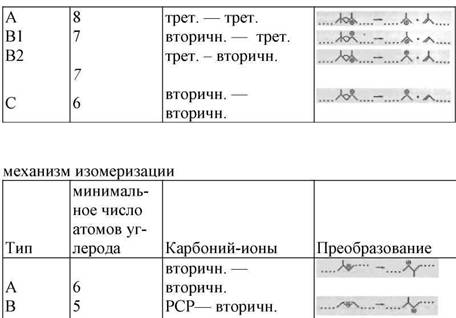
Возможная изомеризация и механизмы β -разрыва для преобразования вторичного и третичного карбонийиона на бифункциональном платиносодержащем катализаторе на основе цеолита .
более устойчивые третичные ионы до крекинга и высокой скорости перехода протона к третичному карбонийиону .
b. Влияние отношения гидрирующей и кислотной функций и геометрии пор. Отношение изопарафинов к н-парафинам в продуктах увеличивается с уменьшением температуры реакции, потому что с ростом температуры скорость крекинга изопарафинов увеличивается быстрее чем н-парафинов. Это проиллюстрировано на примере гидрокрекинга n-декана (Рисунок 4.2) . Отношение изо-парафинов к н-парафинам также увеличивается в случае, если катализатор содержит слабый гидрогенизационный компонент и сильный кислотный компонент, что объясняется более высокой скоростью изомеризации промежуточных олефиновых углеводородов на сильных кислотных центрах. И наоборот, частичная нейтрализация кислотных центров аммиаком в течение гидрокрекинга уменьшает не только активность крекинга но и отношение изо-парафинов к н-парафинам в получаемых продуктах. Распределение продуктов, полученных при гидрокрекинге цетана на катализаторах с различными гидрирующими компонентами и различными основами показаны на Рисунке 4.3: более высокое отношение гидрирующей и кислотной функций катализатора (например Pt/CaY, Pt/USY) приводит к более широкому распределению продуктов . Такой гидрокрекинг иногда называют "идеальным гидрокрекингом" и его результатом часто являются более высокие выходы жидких продуктов. При "идеальном гидрокрекинге" стадии, определяющие скорость реакции, (изомеризация и β -разрыв) происходят на кислотных центрах, тогда как металлические центры служат только для быстрого гидрирования и дегидрирования .
Широкое распределение продуктов также предполагает высокую скорость десорбции и гидрирования первичных продуктов крекинга прежде, чем может произойти вторичный крекинг. Высокая скорость десорбции карбоний-иона обусловлена их вытеснением
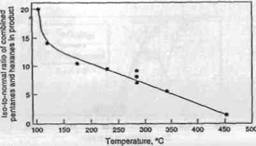
Рисунок 4.1. Влияние температуры реакции на отношение изо-парафинов к н-парафинам в продуктах, полученных при гидрокрекинге n-декана на ката-лизаторе с сильной кислотной функцией .
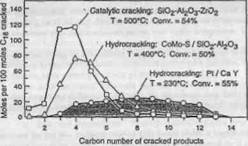
4.2 Распределение углеродного числа при каталитическом крекинге и гидрокрекинге цетана при 50%-ой конверсии .
n-олефинами, концентрация которых в устойчивом состоянии выше в присутствии сильного гидрирующего-дегидрирующего компонента (конкурирование сорбции и десорбции) . Таким образом сила гирдирующегодегидрирующего компонента может влиять на скорость десорбции третичных карбоний-ионов и сказываться на распределении продуктов. Данные на Рисунке 4.3 также показывают, что молекулы с длинной цепью имеют тенденцию крекироваться в центре или около него, потому что в продуктах отсутствуют углеводородыC1 или C2.
На катализаторах же с низкими отношениями силы гидрирующей и кислотной функций (например, Co-Mo-S/SiO2-Al2O3), осколки первичных реакций крекинга остаются адсорбируемыми на кислотных центрах и подвергаются вторичному крекингу. Это приводит к более высоким выходам низкомоле-кулярных продуктов (C2-C6) (Рисунок 4.3).
Гидрокрекинг на катализаторе, состоящем из сильного гидрирующего компонента (например, Pt) и слабого кислотного или нейтрального компонента протекает по механизму гидрогенолиза на металле . Это приводит к высоким выходам C1 и C2 углеводородов, н-парафинов и почти отсутствию изо-парафинов.
Используя для исследования n-гептан и катализаторы гидрокрекинга, содержащие различные цеолиты, Гвиснет (Guisnet) и др. исследовал влияние отношения гидрирующей и кислотной функций и геометрии пор на активность катализатора и его селективность. Авторы нашли, что для катализаторов PtHY и PtHZSM-5 активность увеличивается с ростом отношения гидрирующей и кислотной функций до достижения определенного уровня. Катализатор Pt,H-морденит показал увеличение с последующим снижением активности с ростом отношения гидрирующей и кислотной функций. Наблюдаемые различия в активности были приписаны различиям в геометрии пор цеолита: PtHY и PtHZSM-5 имеют трехмерный каркас, который облегчает диффузию молекул сырья и продуктов, в то время как морденит имеет одномерную структуру пор. В мордените, поры могут быть легко блокированы платиной или коксом, сокращая активность катализатора и ведя к быстрой его дезактивации .
Селективность катализатора также определяется отношением гидрирующей и кислотной функций. Отношение изомеризованного n-гептана к крекированному увеличивается с ростом отношения гидрирующей и кислотной функций . Присутствие сильного гидрирующего компонента увеличивает скорость гидрирования изоолефиновых осколков, образованных на кислотных центрах из начальных молекул сырья, что приводит к более высоким выходам изомеризованных продуктов.
При низких температурах и низких уровнях конверсии, преобладает гидроизомеризация n-парафинов. С увеличением температуры, степень гидроизо-меризации проходит максимум и начинает уменьшаться, тогда как степень гидрокрекинга растет (Рисунок 4.4) . Уменьшение степени гидроизомери-зации при более высоких температурах происходит из-за гидрокрекинга разветвленных изомеров. Судя по этим результатам, можно предположить, что скелетная изомеризация предшествует разрыву C-C связей. Рост длины цепи n-парафина приводит к уменьшению требуемой температуры реакции и для гидроизомеризации и для гидрокрекинга. Число разветвленных изомеров и продуктов крекинга значительно увеличивается с ростом длины цепи. При высокой жесткости гидрокрекинга, первичные продукты крекинга подвергаются вторичной изомеризации и крекингу. Скорость вторичного гидро-преобразования увеличивается с ростом длины цепи фрагмента. Также могут иметь место другие вторичные реакции, такие как диспропорционирование, циклизация и коксообразование.
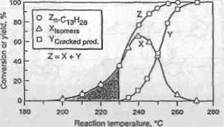
Рисунок 4.3 Влияние температуры реакции на изомеризацию и гидрокрекинг n-С13 на Pt/CaY катализаторе на основе цеолита.
Гидропреобразование нафтеновых углеводородов
Реакции гидрокрекинга нафтеновых были описаны в многочисленных публикациях. Как и в случае парафинов, большинство исследований относительно превращений нафтеновых углеводородов было выполнено с использованием образцовых составов. Эти работы показали, что главные реакции нафтеновых с одним пятичленным или шестичленным кольцом на бифункциональных катализаторах гидрокрекинга - это скелетная изомеризация и гидрокрекинг, подобные наблюдаемым для н-парафинов. Кроме того, нафтеновые у.в. имеет сильную тенденцию к диспропорциони-рованию .
 к циклической форме , например: к циклической форме , например:
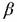 -разрыва. Третье объяснение было выдвинуто Бранденбергом (Brandenberger) и др. . Из экспериментов по раскрытию кольца метил-циклопентана авторы заключили, что имеет место так называемый прямой механизм раскрытия кольца через нестандартные карбоний-ионы. По этому механизму кислый протон непосредственно атакует C-C сигма-связь с образованием пента-ориентированного атома углерода и двухэлектронных, трехцентровых связей (Рисунок 4.5, 1). Карбоний-ион раскрывается, для образования нециклического карбоний-иона (рисунок 4.4, II), который впоследствии стабилизируется по механизму, описанному для парафинов. Данные, полученные другими авторами подтверждают справедливость -разрыва. Третье объяснение было выдвинуто Бранденбергом (Brandenberger) и др. . Из экспериментов по раскрытию кольца метил-циклопентана авторы заключили, что имеет место так называемый прямой механизм раскрытия кольца через нестандартные карбоний-ионы. По этому механизму кислый протон непосредственно атакует C-C сигма-связь с образованием пента-ориентированного атома углерода и двухэлектронных, трехцентровых связей (Рисунок 4.5, 1). Карбоний-ион раскрывается, для образования нециклического карбоний-иона (рисунок 4.4, II), который впоследствии стабилизируется по механизму, описанному для парафинов. Данные, полученные другими авторами подтверждают справедливость
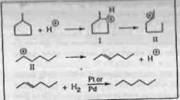
Рисунок 4.4 Механизм прямого открытия кольца метил-циклопентана через нестандартный карбоний ион .
этой теории . Позже, Хаг (Haag) и Дессау (Dessau) показали, что при высоких температурах этот механизм справедлив также для крекинга парафинов.
Реакция укорачивания цикла. Реакция укорачивания цикла была открыта в начале 1960-ых годов группой из Шеврона (Chevron) . Авторы нашли, что алкилированные циклогексаны с общим количеством атомов углерода 10-12, подвергаются гидрокрекингу очень избирательно. Алкилированные группы были отсоединены от нафтенового кольца. Продукты, получающиеся в ходе реакции, - изобутан и циклический углеводород с количеством атомов углерода на четыре меньше, чем исходный нафтеновый углеводород. Продукт содержит очень небольшое количество метана и имеет высокое отношение изо-парафинов к н-парафинам. Предложенный механизм для гидрокрекинга тетраметил-циклогексана показан на Рисунке 4.5 .
Рисунок 4.5 Механизм реакции укорачивания цикла .
Высокая концентрация изобутана и циклических углеводородов в продуктах, наряду с практически отсутствием метана, может быть объяснена если учитывать два основных принципа гидрокрекинга нафтеновых углеводородов: (a) интенсивная скелетная изомеризация, предшествующая β -разрыву и (b) низкая скорость крекинга C-C связей кольца . Из рисунка 4.7 видно, что скелетные преобразования происходят в несколько степеней, пока не будет достигнута конфигурация, благоприятная для β -разрыва типа A связей вне кольца. Это приводит к получению метил-цеклопентена и третичному бутил-катиону, которые стабилизируются также, как и насыщенные углеводороды по обычному бифункциональному механизму. Для нафтеновых у.в. механизм требует как минимум 10 атомов углерода для возможности осуществления β -разрыва типа A (формирование двух третичных осколков; см. Рисунок 4.1) Это объясняет, почему скорость и селективность крекинга значительно уменьшаются (более чем 100 раз), при замене нафтенового углеводорода C10 на C9. Стабильность кольца наблюдалась также для больших циклов, например для циклододекана .
Меньше сведений имеется относительно гидрокрекинга полинафтеновых углеводородов. Например, декалин, нафтеновый углеводород с двумя кольцами, был подвергнут гидрокрекингу с образованием легких парафинов с высоким отношением изо-парафинов к н-парафинам и получением нафтеновых углеводородов с одним циклом, с высоким отношением метил-циклопентана к циклогексану. Распределение продуктов указывает на раскрытие одного из двух колец, с последующим преобразованием алкилированного нафтенового углеводорода с одним циклом, как описано выше.
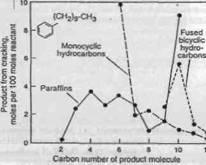
Рисунок 4.6 Распределение продуктов, полученное для гидрокрекинга n-децил-бензола при 288°C и 82 атм .
Гидропреобразование алкилароматических углеводородов Было исследовано множество реакций гидрокрекинга алкилароматических углеводородов . Наблюдаемые при этом реакции - изомеризация, деалкилирование, смещение бокового радикала, укорачивание цикла и цик-лизация. Результатом данных реакций является широкий спектр продуктов реакций.
Гидрокрекинг алкилбензолов с боковыми цепями с тремя - пятью атомами углерода дает относительно простые продукты. Например, гидрокрекинг n-бутил-бензола имеет результатом прежде всего бензол и n-бутан. Также имеют место изомеризация с образованием изобутана и перемещение боко-вой цепи с образованием бензола и дибутил-бензола. Чем больше боковая цепь, тем более сложным получается распределение получаемых продуктов. В последнем случае, может наблюдаться также циклизация. Это подтвержде-но гидрокрекингом n-децил-бензола на алюмо-кремниевом катализаторе с содержанием NiS (Рисунок 4.7) . Простое деалкилирование с образованием бензола и декана является все еще самой основной реакцией, но в то же вре-мя наблюдается множество других реакций, включая и циклизацию. Значи-тельное количество C9-C12 полициклических углеводородов, такие как тет-ралин и индан, найдено в продуктах. Гидрокрекинг полиалкилбензолов с ко-роткими боковыми цепями, типа гексаметил-бензола, приводит к образова-нию легких изопарафинов и C10, C11-метилбензолов как основных продуктов (Рисунок 4.8) . Разрыв кольца практически не наблюдается. Были пред-ложены различные механизмы реакции Один из механизмов, пред-ложенный Салливаном (Sullivan), является подобным предложенному для ре-акции укорачивания цикла полиметил-циклогексана (см. Рисунок 4.7) . Если используются катализаторы со слабой кислотной функцией, типа гид-рирующих металлов на оксиде аллюминия, то основной реакцией будет по-следовательное удаление метильных групп (гидрогенолиз), изомеризация в этом случае минимальна.
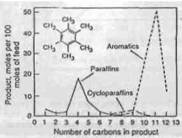
Рисунок 4.7 Распределение продуктов, полученных при гидрокрекинге гек-саметил-бензола при 349°C и 14 атм .
|