Коррозия и защита от коррозииОсновы теории коррозии металлов
ГАЗОВАЯ КОРРОЗИЯ МЕТАЛЛОВ
Общая характеристика процессов газовой коррозии
Газовая коррозия протекает при контакте металлов с газами в отсутствии электропроводящих растворов.
В природных условиях газовая коррозия встречается редко, а в технологических процессах, особенно в металлургических и химических производствах, — достаточно часто.
Как правило, газовая коррозия протекает по химическому механизму.
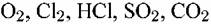 и т.д. и т.д.
Пример. В промышленности синтез хлористого водорода из хлора и водорода осуществляют при 1000-1200° С. Если при этом применяют металлические печи, то внутренняя поверхность печи подвержена газовой коррозии. В зависимости от содержания хлора и водорода в смеси газов протекают реакции:
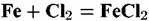
или
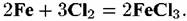
Железо выступает в качестве восстановителя, хлор — окислителя, а на поверхности металла образуется солевая пленка.
Наиболее часто химический механизм реализуется в процессах газовой коррозии и в жидкой среде неэлектролитов.
Для большинства процессов основным условием осуществления химической коррозии является отсутствие на поверхности металла пленки воды. Это требование может быть достигнуто при соблюдении одного из трех условий:
реагирующие газы содержат минимальное количество влаги (как правило, не более сотых долей процента);
контакт металла и газов осуществляется при высоких температурах, превышающих точку росы, когда конденсация влаги на поверхности металла не происходит;
металл находится в среде неполярных органических соединений.
В технологических процессах часто вводят стадию осушки газов для снижения их коррозионной активности.
Пример. Влажный хлор является коррозионноактивной средой. В нем стойки только титан или графитовые материалы. Поэтому заключительной стадией производства хлора является осушка газа серной кислотой, что позволяет снизить содержание влаги до 0,003-0,04 %. При соблюдении этих условий скорость коррозии резко снижается и возможно применение стальной аппаратуры и трубопроводов. Аналогичную операцию проводят при получении брома, понижая на последних стадиях процесса содержание влаги до 0,003-0,01 %.
Академик П.А. Ребиндер классифицировал формы связи воды с материалом в зависимости от энергии связи. Вода в адсорбционных слоях (физико-химическая связь) отличается от свободной воды как по химическим, так и по термодинамическим свойствам. Диэлектрическая постоянная адсорбированной воды в 40 раз меньше, чем у свободной воды, а температура замерзания на несколько десятков градусов ниже. Предполагают, что при контакте металла с газами, содержащими до 0,05 % Н2О, на поверхности металла находится только физико-химически связанная вода.
Область существования высокотемпературной газовой коррозии определяется интервалом температур. Нижняя граница соответствует температуре конденсации пара на поверхности металла. Это состояние, называемое точкой росы, зависит от парциального давления паров воды. Для воздуха при атмосферном давлении оно оценивается температурой, равной 240-250°С, а для отходящих газов теплоэлектростанций — 90-100 °С.
При температурах, превышающих точку росы, начинается область химической газовой коррозии.
Верхняя температурная граница определяется такими свойствами металла, как жаростойкость и жаропрочность.
Жаростойкость характеризует способность металла сопротивляться коррозионному воздействию газов при высокой температуре.
Жаропрочность определяет способность материала в условиях высокотемпературного воздействия сохранять хорошие механические свойства, длительную прочность и сопротивление ползучести.
Металл может быть жаростоек, но не жаропрочен, и наоборот — жаропрочен, но не жаростоек.
Так, например, жаропрочные стали на основе железа можно эксплуатировать при температурах до 700° С, алюминиевые и медные сплавы — до 400-450 °С, свинец — до 150 °С. Эффективное сочетание жаропрочности и жаростойкости достигается в сплавах системы никель-хром — до 1000° С.
Высокотемпературное взаимодействие металлов с окислительной средой имеет место при многих химических процессах.
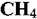 осуществля- осуществля-
 при дав- при дав-
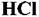 при 1000-1200 °С, хлорирование метана при 400-450 °С, получение метилового спирта СНзОН при 375-400°С, крекинг нефтепродуктов выше 450 °С. при 1000-1200 °С, хлорирование метана при 400-450 °С, получение метилового спирта СНзОН при 375-400°С, крекинг нефтепродуктов выше 450 °С.
Во всех приведенных примерах поверхность аппаратов подвергается воздействию агрессивной газовой среды, что должно привести к образованию на металле оксидных или солевых соединений.
|