Коррозия и защита от коррозииПассивность
Пассивность — это состояние высокой коррозионной стойкости металлов и сплавов, находящихся в агрессивной среде, в определенной области потенциалов (рис. 4.11).
Скорость процесса растворения металла в области пассивации становится и может сохраняться сколь угодно долго на несколько порядков величины (в отдельных случаях до 10 порядков) более низкой, чем в области активного растворения.
С точки зрения термодинамики смещение потенциала электрода в положительную сторону должно приводить к увеличению термодинамической вероятности протекания электрохимической реакции растворения металла. В действительности этого не происходит.
Явление пассивации наглядно показывает, как на практике зачастую трудно бывает реализовать термодинамическую возможность.
Открытие пассивации более 150 лет назад связывают с именем английского физика М. Фарадея, хотя первое описание этого явления встречается в трудах М.В. Ломоносова (1738 г).
Обратимся к рис. 4.22, на котором на примере железного электрода изображена поляризационная кривая в растворе серной кислоты. Как видно, при анодной поляризации первоначально (участок 7) наблюдается рост плотности тока, который характеризует область
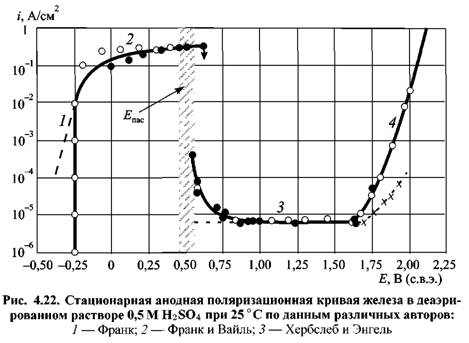
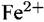
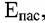 который часто называют Фладе потенциалом, наблюдается резкое, на несколько порядков, снижение плотности тока и металл переходит в область пассивного состояния. Здесь величина тока не зависит от потенциала и скорости размешивания электролита. который часто называют Фладе потенциалом, наблюдается резкое, на несколько порядков, снижение плотности тока и металл переходит в область пассивного состояния. Здесь величина тока не зависит от потенциала и скорости размешивания электролита.
 . При потенциалах от +0,5 до +0,8 В . При потенциалах от +0,5 до +0,8 В
 ) при 25 °С имеют следующие значения: ) при 25 °С имеют следующие значения:
 не известен. не известен.
 с различным соотношением количества компонентов, меняющимся по толщине пленки. Вследствие этого, как отмечалось ранее, защитная способность пассивирующих пленок на с различным соотношением количества компонентов, меняющимся по толщине пленки. Вследствие этого, как отмечалось ранее, защитная способность пассивирующих пленок на
поверхности железа не велика. Толщина пассивирующих пленок, образующихся на железе, зависит от кислотности раствора и потенциала металла.
Область пассивности при дальнейшем смещении потенциала электрода в положительную сторону сменяется областью перепассивации, в которой вновь наблюдается рост тока (участок 4 на рис. 4.22). Подобная картина зависимости плотности тока от потенциала характерна не только для железа в серной кислоте, но и для многих других металлов.
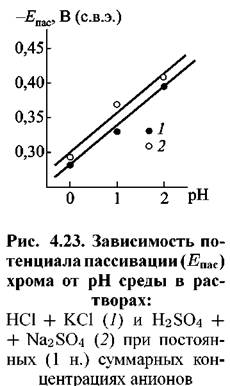
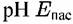 этого металла смещается в отрицательном направлении (в данном случае на 58 мВ при изменении рН на единицу). этого металла смещается в отрицательном направлении (в данном случае на 58 мВ при изменении рН на единицу).
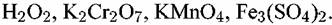
 . С учетом этого обстоятельства можно заключить, что кислородсодержащие окислители (как пассиваторы) могут рассматриваться в качестве частиц, обладающих кислорододонорной способностью по отношению к металлам. . С учетом этого обстоятельства можно заключить, что кислородсодержащие окислители (как пассиваторы) могут рассматриваться в качестве частиц, обладающих кислорододонорной способностью по отношению к металлам.
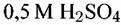 в присутствии раз- в присутствии раз-
личных окислителей было показано, что роль добавок сводится к изменению потенциала электрода, который и определяет электрохимические и коррозионные свойства металла, в том числе и переход его в область пассивации.
Закономерности поведения металла в пассивном состоянии во многом определяются свойствами пассивирующих пленок. Так, если пленка медленно взаимодействует с электролитом, имеет полупроводниковую проводимость, то практически вся приложенная разность потенциалов падает внутри пленки, и тогда область пассивации может наблюдаться до очень высоких значений потенциала. При этом практически весь протекающий через систему ток будет расходоваться на прирост толщины оксидной пленки. Подобный вид зависимости наблюдается на титане, тантале, ниобии.
Если поверхностные пленки обладают высокой электронной проводимостью, то при анодной поляризации на границе пленка-раствор может возникнуть разность потенциалов, достаточная для протекания процесса разложения молекул воды с образованием кислорода, или возникнет процесс перепассивации. В любом случае этим явлениям будет отвечать рост тока (участок 4 на рис. 4.22). Перепассивация связана с изменением свойств пассивирующей пленки, результатом чего являются локальные разрушения и образование питтингов.
Для рассматриваемого примера коррозии железа в сернокислых растворах рост плотности тока отвечает одновременному протеканию двух процессов — питтингообразованию и выделению кислорода.
Одна из признанных теорий, нашедших экспериментальное подтверждение, была предложена в 80-х годах Макдональдом и сотрудниками. Она объясняет природу поведения метала и пленок в области пассивного состояния и достаточно хорошо согласуется с экспериментальными результатами.
Модель базируется на представлении об оксидной пленки на металле как кристаллической структуре с большим количеством точечных дефектов — кислородных и катионных вакансий (см. гл. 2). Вакансии кислорода образуются на границе металл—пленка и поглощаются на границе пленка-раствор. Именно их движение в пленке в направлении от границы с металлом к границе с раствором приводит к росту толщины оксидной пленки. Здесь можно привести аналогию с механизмом образования оксидных пленок при газовой коррозии.
Другой взаимосвязанный процесс — это движение катионных вакансий в пленке от границы раствор-пленка к границе пленка-металл, который и обуславливает растворение металла.
В целом процесс формирования оксидного слоя сопровождается параллельным процессом растворения металла. В зависимости от толщины пленки меняются закономерности ее роста. С уменьшением толщины пленки логарифмический закон роста переходит в параболическую зависимость.
|