Коррозия и защита от коррозииОбщая характеристика электрохимического коррозионного процесса
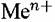 ) коррозионные процессы принято называть процессами растворения металлов. Образование ионов металла из его атомов, например, в кислом растворе электролита можно представить совокупностью реакций: ) коррозионные процессы принято называть процессами растворения металлов. Образование ионов металла из его атомов, например, в кислом растворе электролита можно представить совокупностью реакций:
в которой электроны освобождаются, и
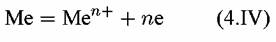 электроны, освободившиеся в реакции (4.IV), присоединяются к ионам водорода. В результате на металле одновременно протекают две реакции — анодная (4.IV) и катодная (4.У). электроны, освободившиеся в реакции (4.IV), присоединяются к ионам водорода. В результате на металле одновременно протекают две реакции — анодная (4.IV) и катодная (4.У).
Перенос электронов осуществляется на поверхности металла, а перемещение ионов — в электролите. Явления, которые при этом происходят, изображены на рис. 4.7.
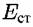 . Этот потенциал называют стационарным или смешанным (компромиссным) потенциалом. . Этот потенциал называют стационарным или смешанным (компромиссным) потенциалом.
 соблюдается равенство катодного и анодного токов, т.е. соблюдается равенство катодного и анодного токов, т.е.

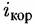 — скорость коррозии или саморастворения металла. — скорость коррозии или саморастворения металла.
Если бы при этом электродные процессы не протекали, то потенциалы электродов сравнялись бы и наступила полная поляризация.
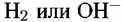 . Таким образом, если из двух реакций противоположенного направления, одновременно протекающих на металле в отсутствие внешнего тока, одна является реакцией растворения, а другая - реакцией восстановления какого-либо окислительного компонента раствора, например, ионов водорода, то это и есть коррозионный процесс. . Таким образом, если из двух реакций противоположенного направления, одновременно протекающих на металле в отсутствие внешнего тока, одна является реакцией растворения, а другая - реакцией восстановления какого-либо окислительного компонента раствора, например, ионов водорода, то это и есть коррозионный процесс.
Под коррозией, таким образом, понимают самопроизвольный процесс, идущий на металле в условиях, когда металл погружен в раствор и ток от внешнего источника через него не проходит.
Изучать процессы коррозии можно и при наложении внешнего тока. Для получения информации о скорости коррозии нужно пропускать через металл ток (поляризовать его) и использовать принцип построения поляризационных кривых.
Если электрод подключить к отрицательному полюсу источника тока, то его потенциал сдвигается в отрицательную сторону. Подключение электрода к положительному полюсу дает возможность сдвигать потенциал в положительную сторону. Если фиксировать при этом одновременно значения тока и потенциала, то можно получить катодную и анодную поляризационные кривые.
 внешний ток внешний ток
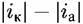
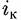 в последнем равенстве можно пренебречь. в последнем равенстве можно пренебречь.
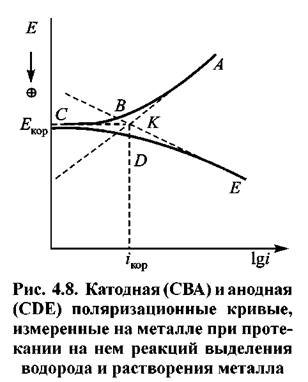
На рис. 4.8 приведены поляризационные катодная (СВА) и анодная (СОЕ) кривые выделения Н2 и растворения металла.
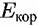 и плотность и плотность
тока гкор называются потенциалом коррозии и скоростью коррозии. Потенциал коррозии часто называют также стационарным или коррозионным потенциалом. Иногда применяют термин потенциал свободной коррозии. Прямые АК и КЕ выражают зависимость от потенциала истинных скоростей парциальных процессов выделения водорода и растворения металла.
При катодной поляризации скорость выделения водорода возрастает, а скорость растворения металла уменьшается. Таким образом, при помощи катодной поляризации можно защитить металл от коррозии. Это явление называется протект-эффектом и используется при защите металлических конструкций. Оно может быть осуществлено или при помощи соединения защищаемого металла с другим металлом, имеющим более отрицательное значение равновесного потенциала, или при помощи внешней катодной поляризации.
Предложенное описание коррозионных процессов справедливо лишь в том случае, если поверхность металла равнодоступна как для анодной, так и для катодной реакций. Для металла с идеально однородной поверхностью (например, для жидкого металла) выполнение такого условия не подлежит сомнению. Для обычных твердых (даже очень чистых) металлов из-за неизбежной неоднородности их поверхности выполнение указанного условия неочевидно. Это явилось причиной появления на первых этапах развития учения об электрохимической коррозии металлов представлений, получивших название теории микроэлементов. Теория предполагала, что катодное восстановление окислителя (например, выделение водорода) может происходить только на некоторых участках поверхности корродирующего металла, а растворение металла возможно на других участках, так что существует пространственное разделение катодной и анодной реакций, позволяющее рассматривать коррозионный процесс как функционирование большого числа короткозамкнутых гальванических элементов.
Теория микроэлементов, оказав в целом положительное влияние на развитие науки о коррозии, не позволяла проводить количественную оценку процессов общей коррозии. Академиком Я.М. Колотыр-киным было показано, что коррозионное поведение твердых металлов в растворах электролитов можно объяснить, не прибегая к представлениям о локальных элементах. Напротив, следует принять, что поверхность металла равнодоступна и для катодной, и для анодной реакций, составляющих коррозионный процесс. Это, в частности, было экспериментально подтверждено следующим опытом.
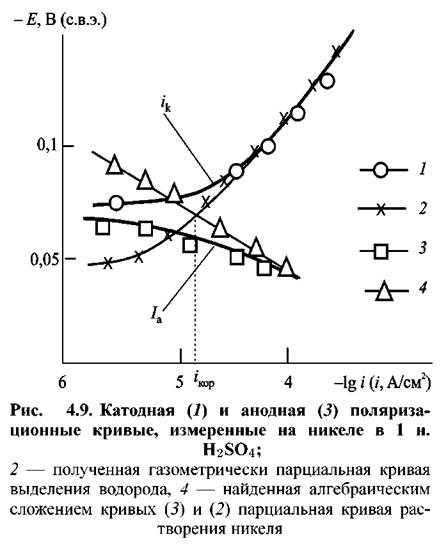
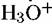 не влияет на скорость растворения металла (рис. 4.9). Анодная поляризационная кривая 3 на этом рисунке при потенциалах вблизи потенциала коррозии отклоняется от тафелевой прямой вследствие снижения анодного тока в результате протекания катодной реакции выделения водорода (2 на рис. 4.9) с соизмеримой скоростью. Внесение поправки на эту реакцию путем алгебраического суммирования внешнего анодного тока и скорости выделения водорода (найденной газометрически и выраженной в единицах плотности тока) приводит к получению линейного отрезка поляризационной кривой (4 на рис. 4.9), проходящего через точки анодной поляризационной кривой, лежащие при достаточно положительных потенциалах. Приведенные данные показывают, что кинетика анодного растворения металла остается одной и той же как в присутствии, так и в отсутствие параллельно протекающего процесса выделения водорода. не влияет на скорость растворения металла (рис. 4.9). Анодная поляризационная кривая 3 на этом рисунке при потенциалах вблизи потенциала коррозии отклоняется от тафелевой прямой вследствие снижения анодного тока в результате протекания катодной реакции выделения водорода (2 на рис. 4.9) с соизмеримой скоростью. Внесение поправки на эту реакцию путем алгебраического суммирования внешнего анодного тока и скорости выделения водорода (найденной газометрически и выраженной в единицах плотности тока) приводит к получению линейного отрезка поляризационной кривой (4 на рис. 4.9), проходящего через точки анодной поляризационной кривой, лежащие при достаточно положительных потенциалах. Приведенные данные показывают, что кинетика анодного растворения металла остается одной и той же как в присутствии, так и в отсутствие параллельно протекающего процесса выделения водорода.
Описанные работы составили основу современной теории растворения металлов. Из них вытекала правомерность приложения к коррозионным процессам, протекающим на твердых металлах, количественных законов электрохимической кинетики.
Таким образом, молено считать, что даже на неоднородных металлах катодные и анодные реакции, составляющие в совокупности процесс коррозии, не являются пространственно разделенными; при коррозии имеет место статическое распределение во времени и в пространстве этих двух процессов.
Забиваем Сайты В ТОП КУВАЛДОЙ - Уникальные возможности от SeoHammer
Каждая ссылка анализируется по трем пакетам оценки: SEO, Трафик и SMM.
SeoHammer делает продвижение сайта прозрачным и простым занятием.
Ссылки, вечные ссылки, статьи, упоминания, пресс-релизы - используйте по максимуму потенциал SeoHammer для продвижения вашего сайта.
Что умеет делать SeoHammer
— Продвижение в один клик, интеллектуальный подбор запросов, покупка самых лучших ссылок с высокой степенью качества у лучших бирж ссылок.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз,
а первые результаты появляются уже в течение первых 7 дней.
Зарегистрироваться и Начать продвижение
В этом случае анализ электрохимических коррозионных процессов состоит в изучении физико-химических закономерностей отдельно катодных и анодных реакций и условий их совместного осуществления.
|