Коррозия и защита от коррозииЭлектрохимическая коррозия металлов
Обязательным условием реализации электрохимического вида коррозии является наличие электропроводящей среды — растворов кислот, щелочей или солей.
В природных условиях электрохимическая коррозия встречается повсеместно. Это, например, атмосферная, морская, подземная коррозия и др.
Такому виду разрушений подвержены магистральные трубопроводы по транспортировке нефти и газа.
 процессы получения минеральных удобрений, хлора, щелочей и т.д. процессы получения минеральных удобрений, хлора, щелочей и т.д.
Явления на границе раздела фаз металл-электролит
Процессы электрохимической коррозии протекают в водных растворах. При соприкосновении металлической поверхности с раствором электролита происходит взаимодействие металла с заряженными частицами раствора и переход ионов метала в раствор. По представлениям А.Н. Фрумкина и его школы в этом случае протекают два сопряженных процесса:
• переход ионов из металла в раствор с образованием сольватированных (в водных растворах — гидратированных) ионов (окислительный или анодный процесс):
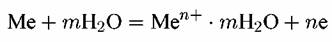
• и переход этих ионов из раствора с выделением их на поверхности металла в виде нейтральных атомов, входящих в состав кристаллической решетки металла (восстановительный или катодный процесс).
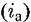 становится равной плотности катодного тока (гк): становится равной плотности катодного тока (гк):

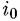 — плотность тока обмена, которая характеризует скорость процесса постоянного обмена ионами между металлом и раствором. При равновесном потенциале одновременно должны осуществляться два условия: — плотность тока обмена, которая характеризует скорость процесса постоянного обмена ионами между металлом и раствором. При равновесном потенциале одновременно должны осуществляться два условия:
на фазовой границе отсутствуют электрохимические и химические превращения;
потенциал самопроизвольно переходит к одной и той же величине как от более высоких, так и от более низких его значений.
Возникновение разности потенциалов между металлом и раствором означает, что на границе раздела фаз (металл / электролит) должны появиться на некотором расстоянии друг от друга положительно и отрицательно заряженные слои, которые и образуют двойной электрический слой — ДЭС (рис. 4.1).
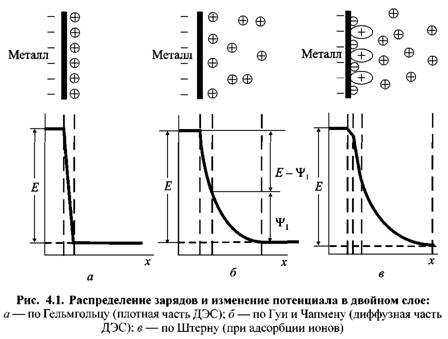
При переходе катионов металла в раствор поверхность металла заряжается отрицательно. К ней притягиваются положительно заряженные анионы. Возникает двойной электрический слой (ДЭС), который подобен структуре плоского конденсатора (рис. 4.1, а). Такие представления о строении ДЭС были выдвинуты немецким ученым Гельмгольцем. Одна из обкладок конденсатора совпадает с плоскостью, проходящей через поверхностные заряды в металле, а другая — с плоскостью, соединяющей центры тяжести зарядов ионов, находящихся в растворе, но притянутых электростатическими силами к поверхности металла.
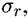 и весь скачок потенциала Е происходит в этой области (рис. 4.1, а). и весь скачок потенциала Е происходит в этой области (рис. 4.1, а).
Гуи развил представления Гельмгольца о структуре ДЭС, приняв, что слои не плотные, а размытые, поскольку плотный ДЭС будет постоянно разрушаться тепловым движением ионов (рис. 4.1, б). В этом случае ДЭС состоит из плотной и диффузной частей этого слоя.
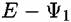 — изменение потенциала в плотной — изменение потенциала в плотной
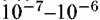 см. см.
Штерн ввел еще одно дополнение в картину о структуре двойного слоя. По его представлениям наряду с образованием плотной части этого слоя в результате максимального приближения ионов к поверхности электрода необходимо учитывать и специфическую адсорбцию дипольных молекул и ионов (рис. 4.1, в).
|